糖皮质激素(Glucocorticoids,GCs)是临床上常用的一种激素,可以调节机体的生长发育、代谢以及免疫功能,常用于抗炎和免疫抑制作用。GCs主要通过与糖皮质激素受体(Glucocorticoid receptor,GR)结合而发挥作用。与配体结合后,GR发生构象变化,并与伴侣蛋白解离,进入细胞核,调控基因表达。大剂量或者长期使用GCs,会导致严重的副作用,比如高血糖、肥胖、骨质疏松等。多个GR LBD的晶体结构表明GR LBD 的构象受到配体结合的严格调节。然而,静态晶体结构不能提供足够的信息来完全理解这些构象变化的动态过程。更好地理解这些结构细节将有助于设计和发现更有效且安全性更高的GR 调节剂。
2021年11月,浙江大学智能创新药物研究院&药学院侯廷军教授课题组通过分子动力学模拟和马尔科夫模型分析,阐明了不同类型的配体对GR H12的构象调节机制,并基于此机制发现了一类新的磺酰胺类GR调节剂。相关工作以标题为“Discovery of novel GR ligands towards druggable GR antagonist conformations identified by MD simulations and Markov state model analysis”发表于国际知名学术期刊《Advanced Science》。

普遍认为GC的副作用主要与GR二聚体诱导的转录激活(transactivation, TA)相关。偏向于诱导转录抑制(transrepression, TR)而不是TA的选择性GR调节剂可能表现出较少副作用。为从原子水平上探究GR调节剂与传统GCs的不同,获得 GR LBD 的可靠构象集合,该研究采用40μs的分子动力学模拟和马尔科夫模型确定了五个主要的GR LBD构象状态(S0, S1, S2, S3, 和 S4)以及五个状态相互转换的通路。此外,研究发现拮抗剂对H12的调节最特殊,由主要经历从拮抗构象S0到拮抗构象S4的变化,这表明副作用相对较小的化合物,有诱导AF2变小的趋势。为验证这一推测,研究团队根据AF2最小的完全拮抗构象开展虚拟筛选,并购买88个化合物进行活性测试。有16 个化合物在 10 μM 下表现出>70%的TR活性,其中HP-19表现出优秀的离体抗炎活性(IC50 = 0.041 ± 0.011 μM)。此外,HP-19不会上调糖皮质激素诱导的亮氨酸拉链蛋白(GILZ),其作用机制不同于地塞米松,是一个有潜力的抗炎先导化合物。
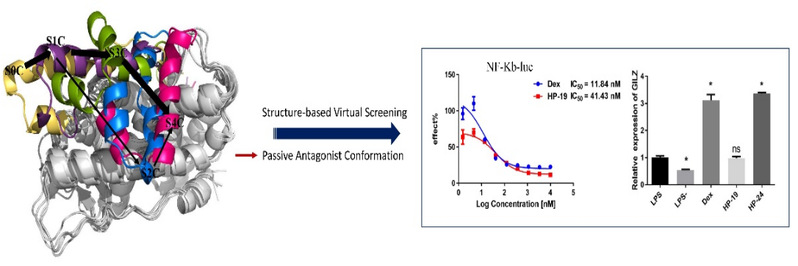
图1 基于MD采样到的AZD9567完全拮抗构象的药物设计
浙江大学智能创新药物研究院&药学院为本论文的第一署名单位,浙江大学药学院博士后胡雪萍,博士研究生庞锦萍、张锦途为论文共同第一作者,侯廷军教授、夏宏光教授和李丹副教授为论文的共同通讯作者。
原文链接:https://doi.org/10.1002/advs.202102435