阿尔茨海默病(Alzheimer’s disease, AD)俗称老年痴呆,是最常见的神经退行性疾病,也是老龄人群中引起痴呆的主要原因。临床上,AD主要表现为以学习和记忆为主的认知功能损伤。AD的特征性病理变化包括细胞外的淀粉样蛋白(amyloid β, Aβ)沉积和细胞内的神经纤维缠结(主要由tau蛋白尤其是高度磷酸化的tau蛋白组成)(1)。此外,AD病理进程中,伴随有以胶质细胞过度激活为特征的炎症反应,近年的研究也发现,天然免疫异常与AD病理密切相关(2)。自1906年由德国精神科医生Alois Alzheimer首次描述以来,针对AD的研究已有近120年的历史。然而,AD的具体发病机制仍不清楚,因此也阻碍了AD相关药物的研发。
近年来,越来越多的实验结果提示,Aβ和tau蛋白的异常聚集可导致突触传递及神经元活性异常,进而影响相关神经环路/网络的结构和功能,最终在AD患者中引起学习和记忆等认知功能的障碍(3)。然而,AD患者脑中突触传递及神经元活性异常的机制及其调控,仍待进一步阐明。
浙江大学医学院脑科学与脑医学学院、双脑中心、医学院附属儿童医院孙秉贵教授课题组在之前的研究中发现,AD小鼠海马中新生神经元的发育及功能整合出现异常(Cell Stem Cell, 2009)(4),调控新生神经元的生成可改善AD小鼠海马齿状回颗粒神经元的突触传递及齿状回和CA1区的突触可塑性,并增强AD小鼠的空间学习和记忆(Stem Cell Reports, 2021)(5, 6)。近日,该课题组在Cell Reports上在线发表题为Aberrant serotonergic signaling contributes to the hyperexcitability of CA1 pyramidal neurons in a mouse model of Alzheimer’s disease的研究论文。该项研究中,作者主要从中缝核至海马的五羟色胺通路的角度,探究AD小鼠CA1神经元活性异常的原因及其调控。

首先,作者以hAPP-J20小鼠作为AD模型,通过在体光纤记录发现,hAPP-J20小鼠海马中CA1锥体神经元的活性明显升高(图1A-C)。电生理检测发现,与野生型(WT)小鼠相比,hAPP-J20小鼠CA1锥体神经元的输入电阻和动作电位初始频率显著升高,而基电流显著下降,提示其兴奋性显著增强(图1D-I);但CA1锥体神经元中sIPSC和sEPSC的频率及幅度在WT与hAPP-J20小鼠之间没有显著差异(图1J-Q)。这些结果提示,hAPP-J20小鼠CA1锥体神经元的过度活跃主要是由于其膜的内在特性异常而引起的。
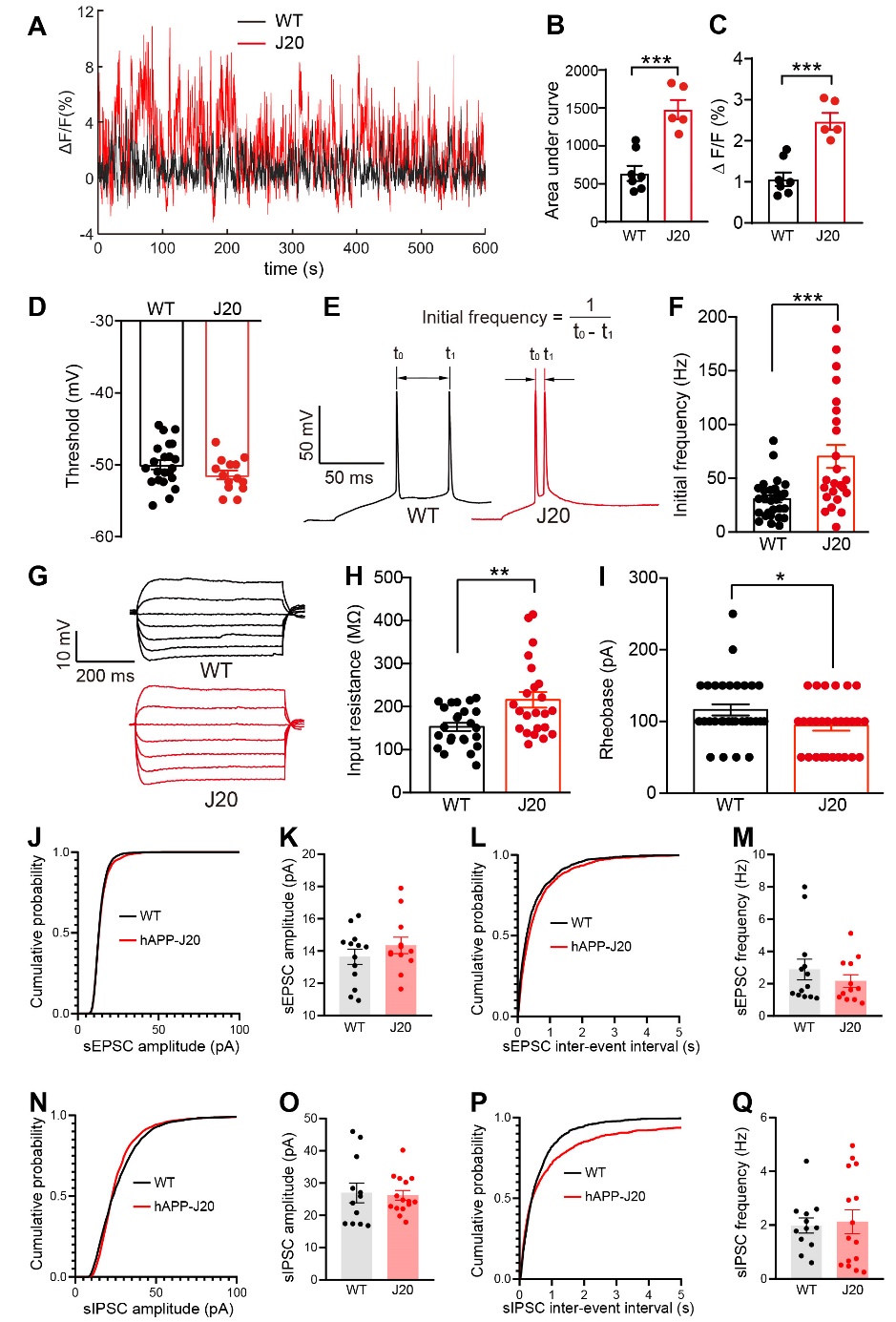
图1. hAPP-J20小鼠中CA1锥体神经元膜的内在特性异常导致其过度兴奋。A-C: 在体光纤记录发现hAPP-J20小鼠CA1锥体神经元活性升高;D-I: 电生理检测发现hAPP-J20小鼠CA1锥体神经元膜的内在特性异常;J-Q: CA1锥体神经元中sIPSC和sEPSC在WT与hAPP-J20小鼠之间无显著差异。
其次,作者利用顺向和逆向追踪、微透析结合HPLC、RNAscope及Western blot等方法发现,中缝核(尤其是median raphe nucleus, MRN)中向海马投射的5-HT神经元数量在WT与hAPP-J20小鼠之间无明显差异,但hAPP-J20小鼠海马中来自MRN的5-HT神经纤维密度增加(图2A-C);然而,hAPP-J20小鼠海马中SERT(5-HT转运体)表达升高(图2D, E)、海马细胞间液中5-HT水平下降(图2F)、5-HT受体(尤其是5-HT1aR和5-HT3aR)的表达也下降(图2G-I),提示hAPP-J20小鼠海马中5-HT相关的信号受到抑制。
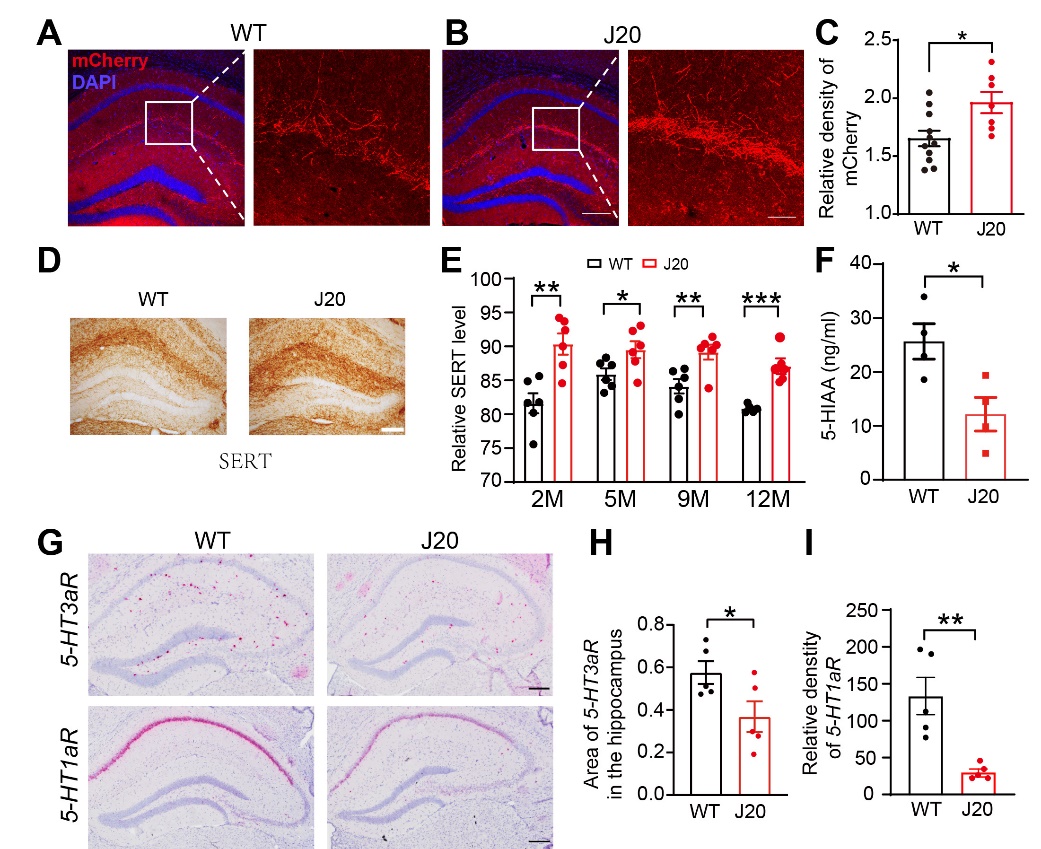
图2. hAPP-J20小鼠海马中5-HT相关信号受到抑制。A-C: hAPP-J20小鼠海马中来自MRN的5-HT神经纤维密度显著增强;D, E: hAPP-J20小鼠海马中SERT表达升高;F: hAPP-J20小鼠海马组织间液中5-HIAA水平降低;G-I: hAPP-J20小鼠海马中5-HT1aR及5-HT3aR的mRNA水平下降。
第三,作者利用化学遗传学调控结合光纤记录及电生理的实验发现,激活MRN中的5-HT神经元可通过影响CA1锥体神经元膜的内在特性及抑制性突触传递而减缓hAPP-J20小鼠CA1锥体神经元的过度兴奋,提示MRN至海马的5-HT通路异常可能是导致hAPP-J20小鼠CA1锥体神经元过度活跃的原因之一。通过药理学方法拮抗5-HT1aR与5-HT3aR后,激活MRN中5-HT神经元影响CA1神经元活性的效果显著减弱,提示5-HT1aR和5-HT3aR在此过程中发挥重要作用。(图3)
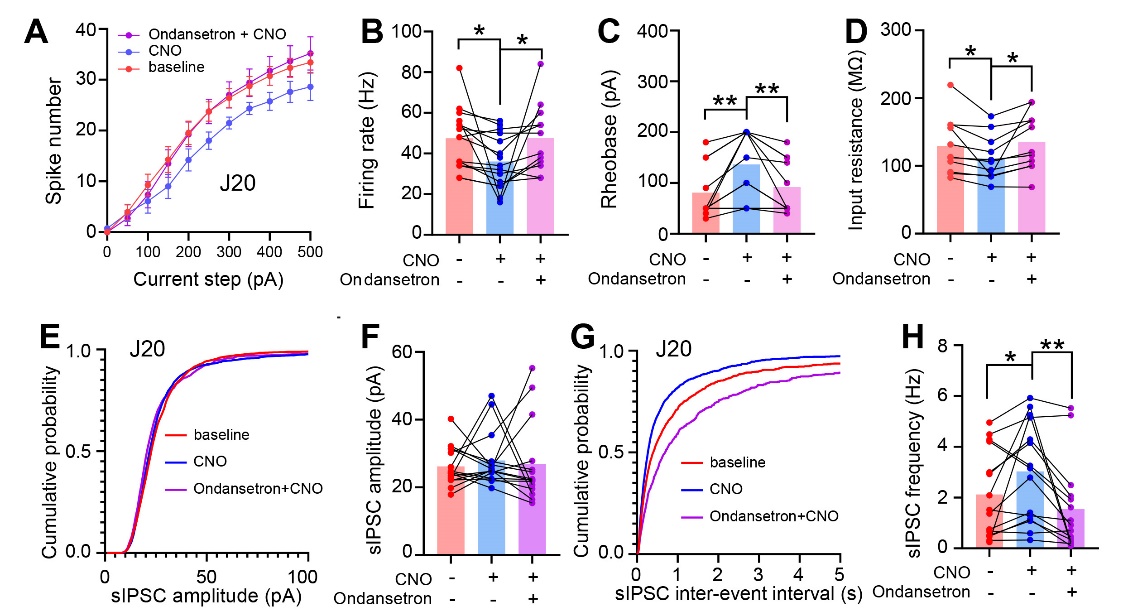
图3. 激活MRN中的5-HT神经元可通过影响神经元膜的内在特性及抑制性突触传递而降低hAPP-J20小鼠CA1锥体神经元的兴奋性。
最后,作者通过化学遗传学调控及药理学方法并结合行为学检测发现,激活MRN中的5-HT神经元可改善hAPP-J20小鼠的记忆能力,而抑制5-HT1aR和5-HT3aR后该效果显著减弱(图4),并且用5-HT1aR和5-HT3aR的激动剂处理小鼠,也可减缓CA1神经元的过度兴奋并显著增强hAPP-J20小鼠的记忆能力。
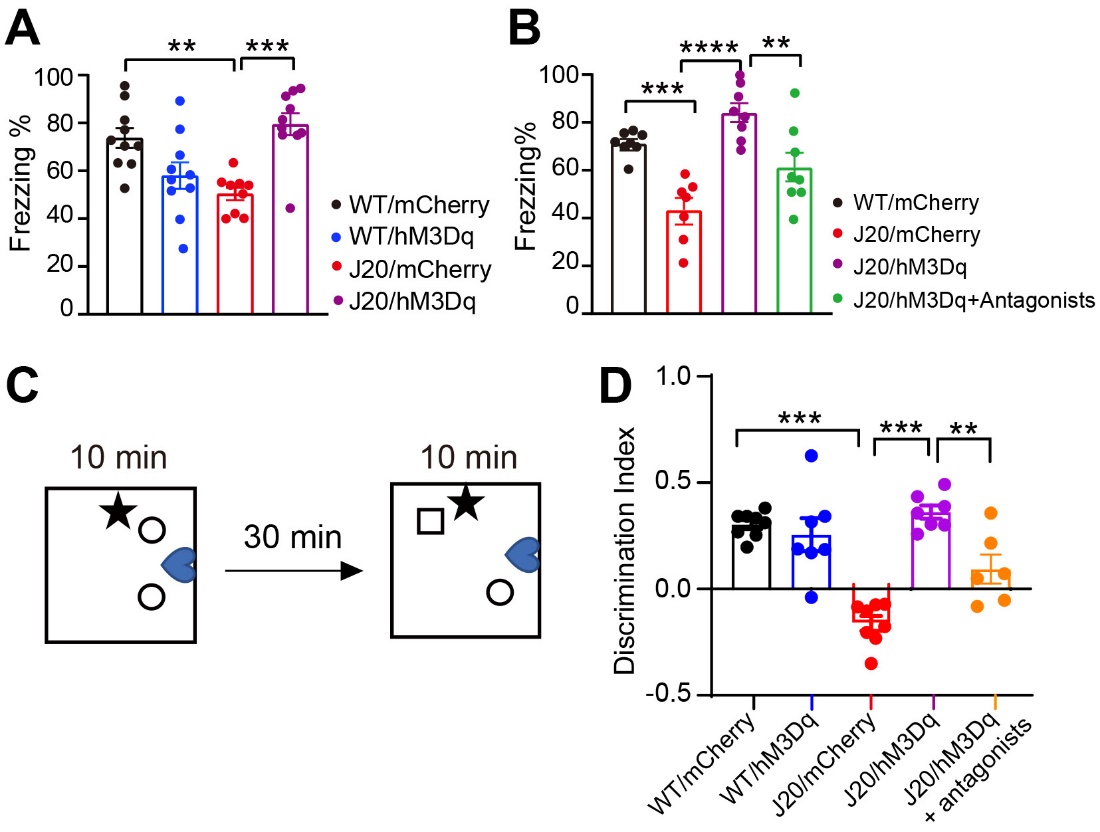
图4. 激活MRN中的5-HT神经元可在5-HT1aR和5-HT3aR介导下改善hAPP-J20小鼠的认知功能。
综上,该项工作的研究结果提示,MRN至海马的5-HT通路异常可导致hAPP-J20小鼠CA1锥体神经元过度兴奋,进而损伤其认知功能(图5)。该工作为深入理解AD的发病机制提供了新的认识,并可能为干预AD提供新的靶点。
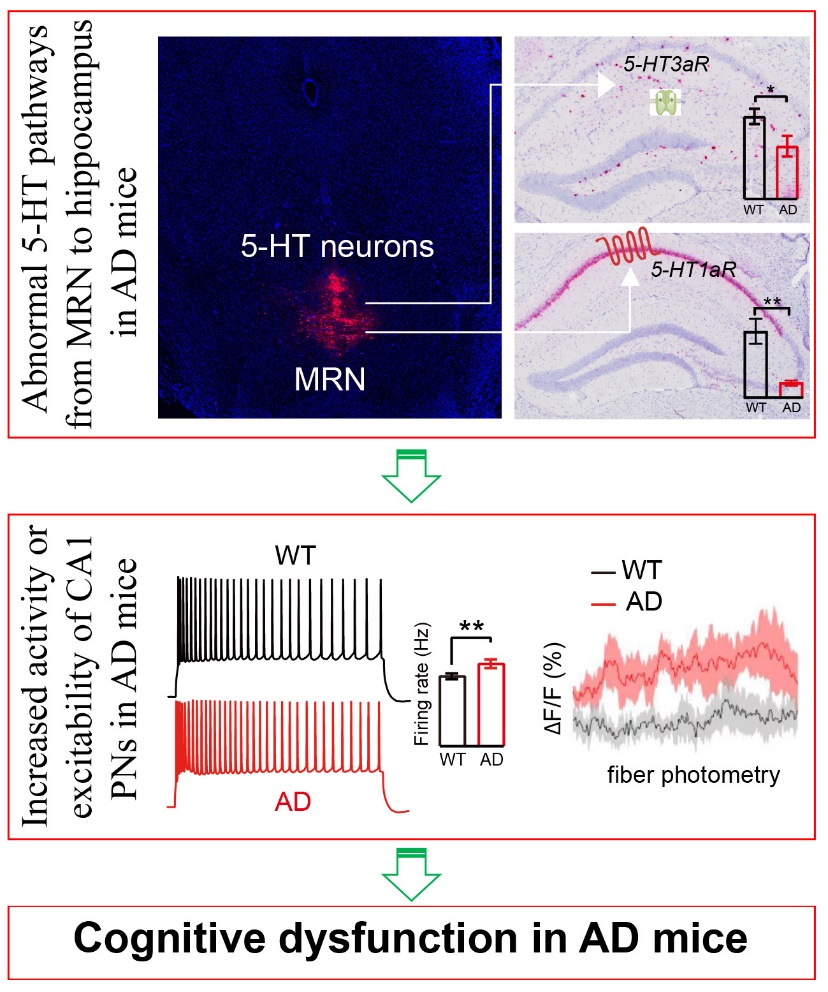
图5. MRN至海马的5-HT通路异常可导致AD小鼠CA1锥体神经元过度兴奋,进而损伤AD小鼠的认知功能。
浙江大学医学院脑科学与脑医学系的博士生王静及梅宇飞博士(武汉科技大学)和张晓琴博士(宁波大学)为论文的共同第一作者,博士后魏小杰及博士生张亦平对论文亦有贡献。课题进行过程中,得到浙江大学医学院李晓明教授、国家健康和疾病人脑组织资源库竺可青副教授及吴娟利老师、浙江大学附属第一医院彭国平主任医师及浙江大学医学院附属儿童医院黄瑾瑾主任和王东坡博士、以及浙江大学医学院公共技术平台等的大力支持。本课题由国家自然科学基金、科技部重点研发计划及浙江省自然科学基金等提供资助,特此致谢!
参考文献
1.D. S. Knopman, H. Amieva, R. C. Petersen, G. Chetelat, D. M. Holtzman, B. T. Hyman, R. A. Nixon, D. T. Jones, Alzheimer disease. Nature Reviews Disease Primers7, 33 (2021).
2.M. Jorfi, A. Maaser-Hecker, R. E. Tanzi, The neuroimmune axis of Alzheimer's disease. Genome medicine15, 6 (2023).
3.M. A. Busche, A. Konnerth, Impairments of neural circuit function in Alzheimer's disease. Philos. Trans. R. Soc. B-Biol. Sci.371, 20150429 (2016).
4.B. G. Sun, B. Halabisky, Y. G. Zhou, J. J. Palop, G. Q. Yu, L. Mucke, L. Gan, Imbalance between GABAergic and Glutamatergic Transmission Impairs Adult Neurogenesis in an Animal Model of Alzheimer's Disease. Cell Stem Cell5, 624-633 (2009).
5.X. Zhang, X. Wei, Y. Mei, D. Wang, J. Wang, Y. Zhang, X. Li, Y. Gu, G. Peng, B. Sun, Modulating adult neurogenesis affects synaptic plasticity and cognitive functions in mouse models of Alzheimer's disease. Stem Cell Reports16, 3005-3019 (2021).
6.X. Q. Zhang, Y. F. Mei, Y. He, D. P. Wang, J. Wang, X. J. Wei, E. L. Yang, D. M. Zhou, H. W. Shen, G. P. Peng, Q. Shu, X. K. Li, B. Y. Luo, Y. D. Zhou, B. G. Sun, Ablating Adult Neural Stem Cells Improves Synaptic and Cognitive Functions in Alzheimer Models. Stem Cell Reports16, 89-105 (2021).
文章链接:https://www.cell.com/cell-reports/fulltext/S2211-1247(23)00163-8